Osteosarcoom
Deze informatie is opgesteld door de afdeling(en) Orthopedie, Oncologie, Willem-Alexander Kinderziekenhuis
Wat is Osteosarcoom?
Een osteosarcoom is een kwaadaardige tumor uitgaande van het bot. Karakteristiek van deze tumor is dat de kankercellen bot produceren (figuur 1).
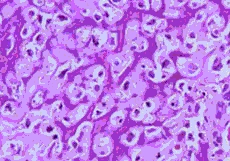
Figuur 1: Osteosarcoom onder de microscoop.
Het is de meest frequent voorkomende bottumor (dus geen uitzaaiing van een andere vorm van kanker) en wordt met name bij adolescenten aangetroffen. De leeftijdspiek ligt tussen de 10-25 jaar. Een tweede leeftijdspiek ligt na de 60 jaar (figuur 2).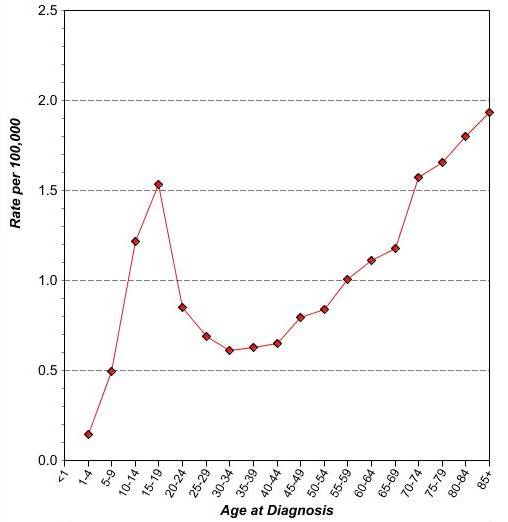
Figuur 2: Leeftijdsverdeling in relatie tot incidentie osteosarcoom per 100.000 (SEER Verenigde Staten 1992-2005).
Een osteosarcoom kan in principe in het hele lichaam voorkomen maar treedt in de meeste gevallen op in de bovenarm of knieregio (60%) in de buurt van de groeischijf (figuur 3). In Nederland gaat het om 35 -45 gevallen per jaar. Een osteosarcoom komt iets vaker voor bij jongens/mannen dan bij meisjes/vrouwen.
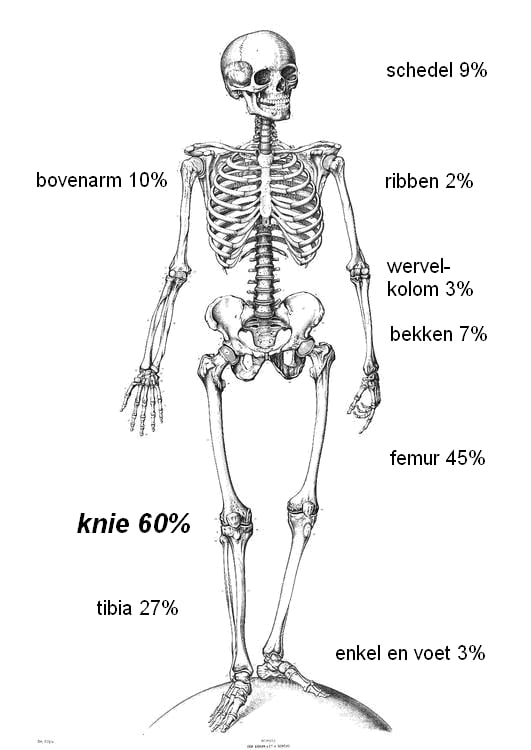
Figuur 3: plaatsen in het skelet waar het osteosarcoom kan voorkomen (Unni 1996, Bielack 2002).
Verschijnselen
Een van de eerste klachten is pijn meestal ook s’ nachts en in rust. De pijn zit meestal in of rond het bot. Soms treedt er een zwelling op. Als deze dicht bij het gewricht is kan er een functiebeperking ontstaan. Tevens kan een spontane botbreuk optreden door de aantasting van het bot. De duur van de symptomen is wisselend, van enkele weken tot enkele maanden.
Oorzaak
Het is niet goed bekend hoe een osteosarcoom ontstaat. Waarschijnlijk is er in de celkern een essentieel stukje DNA beschadigd. Mensen met zeldzame genetische afwijkingen hebben een grotere kans op het ontwikkelen van een osteosarcoom. Dit betreft mensen met het Rothmund-Thomson syndroom, het Bloom syndroom, het Li-Fraumeni syndroom en de familiaire vorm van het retinoblastoom. Maar meestal komt het osteosarcoom sporadisch, dwz in een niet-erfelijke vorm voor. Verder is osteosarcoom vaker dan gemiddeld beschreven bij de ziekte van Paget, na chemotherapeutische behandeling en na bestraling.
Waarom u bij ons in goede handen bent
Patiënten met een osteosarcoom worden in Leiden behandeld in studieverband (EURAMOS-1). Dit betekent dat de behandeling gedaan wordt volgens een protocol, bedacht door een aantal experts in binnen-en buitenland. Het grote voordeel hiervan is dat de behandeling goed gestandaardiseerd is, en dat er regelmatig gekeken wordt of de behandeling aan bepaalde kwaliteitseisen voldoet. Een ander groot voordeel is dat er regelmatig overleg over het protocol gevoerd wordt over het verloop van de studie en of er nog veranderingen doorgevoerd moeten worden, of anderszins dat er nog op of aanmerkingen op het protocol besproken moeten worden. Met deze vorm van samenwerking betekent dat er meestal geen verschil is in behandeling binnen de vier centra in Nederland (AMC in Amsterdam, UMCG in Groningen, UMCN Radboud in Nijmegen en LUMC in Leiden), binnen in Europa en de Verenigde Staten.
Op basis van de ziektegeschiedenis en het lichamelijk onderzoek zijn een aantal diagnostische onderzoeken nodig. Te weten een röntgenfoto van de aangedane plek (Figuur 4 en 5), een MRI (figuur 6 en 7). Met deze beeldvorming wordt gekeken waar de tumor precies zit in het bot, hoe groot de tumor is, hoever de tumor reikt in de omliggende weefsels en hoe de relatie is met de zenuwen en bloedvaten. Uitzaaiingen komen vooral in de longen en botten voor daarom wordt een CT scan van de longen gemaakt en een botscan om uitzaaiingen in het skelet op te sporen. Om met zekerheid vast te kunnen stellen dat het om een kwaadaardige tumor gaat is altijd weefsel nodig van de tumor. Dit wordt weggenomen door middel van een biopsie. De plaats van de biopsie wordt zo gekozen dat het biopsietraject later, bij het wegnemen van de tumor (resectie), kan worden meeverwijderd om achterblijven van kwaadaardige cellen in het biopsietraject te voorkomen.
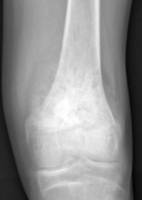
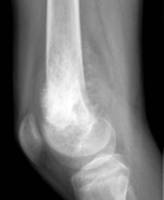
Figuur 4: Röntgenfoto van de knie aan de voorkant Figuur 5: Röntgenfoto van de knie van opzij
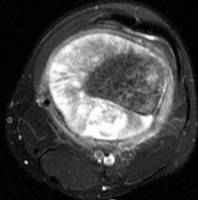
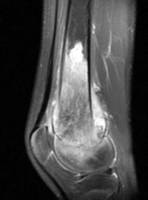
Figuur 6: MRI dwarsdoorsnede Figuur 7: MRI knie
Bloedonderzoek is weinig specifiek, maar soms wordt een verhoging van alkalische fosfatase en/of LDH gevonden.
Welke behandelingen zijn er mogelijk?
De behandeling van een osteosarcoom bestaat uit chemotherapie en een operatie. Het doel van de chemotherapie is de kans op uitzaaiingen te verkleinen en gelijktijdig de tumorcellen zoveel mogelijk te doden waardoor de operatie makkelijker kan worden. De totale behandeling duurt ongeveer ½ tot 1 jaar. In het kort bestaat de behandeling uit enkele weken chemotherapie voorafgaande aan de operatie (gemiddeld 10 weken), de operatie waarbij de tumor uit het bot verwijderd wordt. Het type operatie hangt af van de grootte en lokalisatie van de tumor. Na de operatie volgt nog een chemotherapie periode van 5 – 8 maanden, afhankelijk van de reactie op de chemotherapie. Radiotherapie heeft geen plaats bij de eerste behandeling van een osteosarcoom, omdat de tumor relatief weinig gevoelig is voor bestraling. Radiotherapie kan nog wel eens gebruikt worden in specifieke gevallen.
Chemotherapie
Voor 1970 de periode dat er nog geen chemotherapie voor een osteosarcoom werd gebruikt bestond de behandeling alleen uit chirurgie bij patiënten bij wie geen uitzaaiingen (metastasen) gevonden werden. Chirurgie bestond in dat geval vaak uit een amputatie van het been of de arm waarin het osteosarcoom groeide. Deze patiënten overleden bijna allemaal met terugkerende ziekte. De overleving van een patiënt met een osteosarcoom was toen 15% op lange termijn. Dit betekent, zo redeneerde men, dat het osteosarcoom bij diagnose al uitgezaaid was, maar zonder dat er uitzaaiingen in de longen te zien waren. Dit wordt ook wel micro-metastasering genoemd. Op grond hiervan is men begonnen een patient met een osteosarcoom te behandelen met chemotherapie. Veel artsen hebben zich beziggehouden om de beste combinatie van chemotherapeutische middelen uit te zoeken. Tegenwoordig worden er 4 chemotherapeutische middelen (ook wel cytostatica genoemd) gebruikt die goed werkzaam zijn tegen een osteosarcoom. Dit zijn:
- methotrexaat
- adriamycine (doxorubicine)
- cisplatin
- ifosfamide
Deze middelen worden in een combinatie gegeven, waarvan gebleken is dat Methotrexaat in hoge dosis, samen met de combinatie Adriamycine-Cisplatin, een zogenaamde MAP-kuur zeer effectief is. Bij oudere patiënten wordt soms gekozen voor een Adriamycine-Cisplatinum kuur (AP). Met een dergelijke combinatie waarbij een deel van de totale chemotherapie voor en deel na de chirurgie wordt gegeven (=neo-adjuvant) geneest ongeveer 60% van de patiënten. Dus door toevoegen van chemotherapie verbeterde de overleving met ongeveer 50%.
Omdat het osteosarcoom een zeldzame ziekte is vinden wij het belangrijk om de behandeling te bundelen in ziekenhuizen waar met (inter-)nationale protocollen (TRIALS) voor een osteosarcoom gewerkt wordt. Deze samenwerking komt tot uitdrukking in klinische behandelprotococollen, zoals het EURAMOS-1 protocol. In Leiden heeft het orthopedisch-oncologisch team regelmatig overleg om de behandeling op elkaar af te stemmen.
Chemotherapie heeft veel bijwerkingen. De artsen die deze middelen voorschrijven, (kinder)oncologen, geven uitgebreide uitleg over de gebruikte middelen voordat de behandeling begint. Ondanks preventieve maatregelen kunnen bijwerkingen niet voorkomen worden. Het staat voorop dat de behandeling effectief moet zijn om patiënten met een osteosarcoom een zo groot mogelijke kans op overleving te geven, en daarbij worden een aantal bijwerkingen geaccepteerd.
Chirurgie
In principe heeft er voor de operatie een periode met chemotherapie plaatsgevonden. Twee weken voor de geplande operatie wordt een MRI gemaakt om te kijken hoe de tumor radiologisch gereageerd heeft op de chemotherapie. Het doel van de operatie is al het tumorweefsel te verwijderen (resectie) (figuur 8) met bedekking van het gezonde omringende weefsel waarna het tweede deel van de operatie volgt, het herstellen (reconstructie) van het aangedane lichaamsdeel om een zo optimaal mogelijke functie te behouden. Het type operatie hangt af van de grootte, de lokalisatie en uitbreiding van de tumor in omliggende weefsels zoals spier, gewricht, zenuwen en bloedvaten.

Figuur 8: Dwarsdoorsnede van het aangedane bot
Ledemaat sparende chirurgie
Meestal kan het been of de arm behouden blijven en zal het deel wat verwijderd wordt vervangen worden door:
- donorbot (allograft)
- eigen bot (autograft)
- tumorprothese
Als het gewricht kan worden behouden wordt het defect overbrugd met een gezond stuk bot van uzelf of met donorbot uit de botbank (allograft). Indien er sprake is van het gebruik van donorbot vergt het aan elkaar groeien van de eigen en nieuwe botdelen veel tijd en geduld. Als het defect dicht in de buurt van een gewricht zit (meestal rondom de knie, soms rondom het schouder- of heupgewricht) wordt een kunstgewricht geplaatst. Het voordeel van ledemaat sparende operaties is het behoud van een functioneel been of arm. Het gebruik van een tumorprothese laat snellere belasting toe (Figuur 9 en 10).
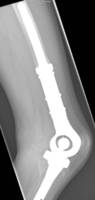

Figuur 9: Röntgenfoto van een tumorprothese van de knie
Figuur 10: tumorprothese van de knie
Omkeerplastiek
Wanneer de tumor zich vlak boven de knie bevindt en het onderbeen en de zenuwen tumor vrij zijn dan kan een omkeerplastiek toegepast worden. Nadat de knie en een deel van het bovenbeen zijn geamputeerd, wordt het onderbeen omgekeerd dus met de hiel naar voren en de tenen naar achteren, aan het resterende deel van het bovenbeen vastgezet. De enkel kan dan als kniegewricht fungeren, waaraan een goed functionerende prothese aangemeten wordt.
Amputatie
Wanneer de tumor door zenuwen en bloedvaten groeit en de orthopeed arm of been niet functioneel kan herstellen is amputatie de enige optie.
Nadat de keuze voor de operatieve ingreep is gemaakt informeert de fysiotherapeut of verpleegkundig specialist u met foto en videomateriaal over de praktische kanten van de ingreep en het te verwachten revalidatie traject. Op de kindergeneeskunde gebeurt dit samen met een pedagogisch medewerkster. Soms wordt ook een lotgenoot ingeschakeld om mee te praten.
De operatie
De operatie duur is afhankelijk van de plaats en de soort operatie. In de wond wordt meestal een drain achtergelaten, dit is een slangetje waardoor wondvocht afgevoerd kan worden. Na de operatie gaat u meestal naar de uitslaapkamer. Wanneer de lichamelijke controles stabiel zijn gaat u naar de verpleegafdeling. In enkele gevallen is het nodig, afhankelijk van de ingreep, dat u bewaakt wordt op de PACU of Intensive Care.
Na de operatie
Pijn
U kunt pijn hebben aan de wond en eventueel ook aan de spieren, maar deze pijn zal meestal na enkele dagen verdwijnen. Bij een amputatie treedt bij ¾ fantoompijn op. Bij een omkeerplastiek heeft u geen fantoompijn omdat de heupzenuw (ischiadicus) niet doorgenomen wordt.
Wond
Het wondverband blijft meestal 2 dagen zitten. De wonddrain wordt binnen 2 dagen verwijderd afhankelijk van de wondvochtproductie. Er zijn speciale pleisters voor de wond waarmee u kunt douchen. De eerste drie weken na de operatie mag u niet in bad gaan om verweking van de huid te voorkomen. Na 3 weken worden de hechtingen op de polikliniek verwijderd.
Katheter
Tijdens de operatie kan een urinekatheter zijn ingebracht. Deze wordt meestal binnen 2 dagen na de operatie verwijderd.
Uit bed
De operateur bepaalt meestal wanneer u uit bed komt. Dit gaat meestal onderleiding van de fysiotherapeut.
Hoe kunt u zich op de behandeling voorbereiden?
Voorbereiding chemotherapie
Voor het toedienen van de chemotherapie worden zogenaamde centraal intraveneuze catheters gebruikt. Dit wil zeggen dat een infuus in een van de grote aders geplaatst wordt die naar het hart toe gaan (meestal in de ondersleutelbeenader). Deze infusen zijn voor langdurig gebruik, en worden operatief ingebracht. Er zijn 2 typen centraal veneuze catheters: Port-a-cath en Hickmann.
Port-a-cath
Dit port-a-cath systeem is speciaal ontworpen om bloedafname en toedienen van medicijnen te vergemakkelijken. Het is een onderhuidse injectiekamer gemaakt van siliconen en titanium. Aan de injectiekamer zit een dunne, siliconen katheter vast. De katheter komt uit in een ader. Met een speciale dunne naald wordt door de huid het siliconen reservoir aangeprikt. De medicijnen of vloeistof gaan via de naald in het reservoir door de katheter en komen direct in de bloedcirculatie. De injectiekamer moet wel steeds worden aangeprikt. De katheter van de Port-A-Cath kan verstopt raken en wordt om dit te voorkomen regelmatig doorgespoten.
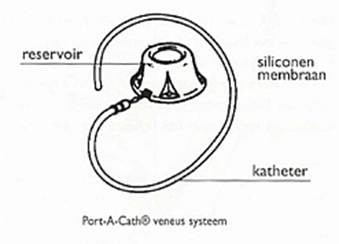
Figuur 11: Een Port-A-Cath katheter
Hickmann catheter
Hickmann catheters zijn getunnelde lijnen die onderhuids lopen en ongeveer 5-10 cm vanuit de insteekplaats door de huid naar buiten komen. Meestal hebben deze centrale lijnen 2 openingen, om tegelijk 2 medicatie infusen te kunnen laten lopen. Tevens kunnen uit beide openingen bloed voor onderzoek afgenomen worden. Het grote nadeel van dit type centraal veneuze lijnen is dat tijdens de periode dat de lijnen zitten, de patiënten niet mogen zwemmen.
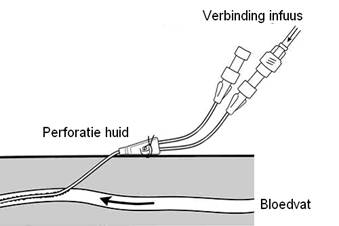
Figuur 12: Aansluiting Hickmann catheter
Voorbereiding op de operatie
- Voor de operatie gaat u langs de anesthesiepoli. Indien nodig worden er nog aanvullende onderzoeken gedaan. U wordt opgenomen de dag voor operatie, of op de operatiedag (nuchter) zelf.
- Wanneer u medicatie gebruikt bijvoorbeeld pijnstillers of bloedverdunners overleg dan met uw arts of u hiermee moet stoppen.
- Bij beenoperaties zijn meestal postoperatief krukken nodig. Deze zijn verkrijgbaar bij de thuiszorgwinkel. De fysiotherapeut op de afdeling stelt de krukken voor u af en leert u lopen.
- Voordat u naar de operatiekamer wordt vervoerd markeert de arts samen met u de geopereerde plek met watervaste stift.
Wat is de prognose?
De genezingskans van alle patiënten met een osteosarcoom ligt rond de 60%. De genezingskans hangt af van de plaats waar de tumor zich bevindt, (hoe goed de tumor te opereren is), de mate van agressiviteit, de reactie van de tumor op de chemotherapie en het al dan niet aanwezig zijn van uitzaaiingen. Geen uitzaaiingen betekent een grotere kans op genezing. Omdat elke situatie en elke persoon uniek is, blijft het moeilijk voorspellingen te doen.
Wat zijn de risico's, bijwerkingen of complicaties?
Bijwerkingen chemotherapie
Hartfunctie
Eén van de belangrijkste chemotherapeutische middelen om het osteosarcoom te bestrijden, adriamycine, kan nadelige effecten op de functie van het hart hebben. Om de pompfunctie van het hart te onderzoeken zal een echo of nucleair onderzoek ejectiefractie worden verricht. Het echo onderzoek wordt vaker bij kinderen gebruikt, de ejectiefractie bij volwassenen. Tijdens en na de behandeling wordt de hartfunctie regelmatig opnieuw bepaald en vergeleken met de eerdere metingen. Bij een echo wordt er gebruik gemaakt van geluidstrillingen en is geen pijnlijk onderzoek.
Gehoor
Cisplatin heeft als bijwerking dat het gehoor beschadigd kan raken, met name in het gebied van de hoge tonen. Daarom wordt voordat de chemotherapie begint een gehoorstest gedaan. Het toonaudiogram is het resultaat van een hoortest die duidelijk maakt in hoeverre u geluiden kunt horen. Het toonaudiogram is een grafiek waarin precies wordt aangegeven in hoeverre u harde, zachte, hoge en lage geluiden wel en niet goed hoort.
Nierfunctie
De nieren zorgen voor de uitscheiding van afvalproducten in ons lichaam. Door cisplatin kunnen de nieren beschadigd worden, waardoor de uitscheidingsfunctie verminderd. Over het algemeen gebeurt dat alleen bij een hogere totaaldosis cis-platin, maar de nieren worden regelmatig gecontroleerd of er ook bij lagere dosis niet al een probleem optreedt met de nierfunctie. Een hoge dosis methotrexaat en ifosfamide kunnen ook de nieren beschadigen.
Haarverlies
Door de chemotherapie valt na ongeveer drie weken na de eerste kuur het hoofdhaar uit, waarvoor men gebruik kan maken van een pruik of andere hoofdbedekking zoals sjaal of pet. Haaruitval kan gepaard gaan met een gevoelige of een pijnlijke hoofdhuid. Ook kunnen wenkbrauwen, wimpers, oksel-, lichaams- en schaamharen uitvallen. Haaruitval is tijdelijk, ongeveer een maand na het beëindigen van de chemotherapie begint het haar weer te groeien. Dit kan in het begin verschil vertonen met het oorspronkelijke haar.
Maag/darmklachten
Door de chemotherapie kan men last krijgen van verminderde eetlust, een vol gevoel, opboeren, zuurbranden, misselijkheid en braken. Tijdens de chemotherapie krijgt men medicijnen tegen de misselijkheid en ook voor de eerste dagen na de kuur omdat men dan nog last kan hebben van misselijkheid. Er wordt geadviseerd om regelmatig kleine maaltijden te gebruiken en goed te drinken.
Vruchtbaarheid en seksualiteit
Door de chemotherapie kan de vrouw veranderingen in haar menstruatiepatroon bemerken. De menstruatie kan heviger/onregelmatiger worden of tijdelijk verdwijnen. Dit kan gepaard gaan met overgangsklachten. Na het beëindigen van de chemotherapie herstelt het menstruatiepatroon zich meestal weer. Bij de man kan het soms 5 jaar duren voor de aanmaak en kwaliteit van het sperma weer hersteld is.
Chemotherapie kan beschadiging van eicellen of zaadcellen veroorzaken, daarom moet een zwangerschap tot enkele maanden na de chemotherapie worden voorkomen. Het is noodzakelijk om door te gaan of te starten met een betrouwbare methode van anticonceptie. Chemotherapie hoeft geen belemmering te zijn voor geslachtsgemeenschap, wel kan het slijmvlies van de vagina droger worden. De behoefte aan seksueel contact kan door vermoeidheid/zwakte afnemen. Afvalstoffen komen in zeer kleine hoeveelheden in het sperma voor, dit is niet schadelijk voor de partner. In de praktijk blijkt dat het vaak mogelijk is zowel voor mannen als vrouwen kinderen te verwekken.
Preservatie Fertiliteit
Hiermee wordt bedoeld wat er gedaan wordt om de late gevolgen van de chemotherapie op de geslachtsorganen zo veel mogelijk terug te dringen. Een belangrijk laat gevolg van de behandeling met chemotherapie is schade aan de geslachtsklieren, met een kans op blijvende onvruchtbaarheid. Ifosfamide en Cisplatin zijn 2 cytostatica die bij een osteosarcoom gebruikt worden en deze schade kunnen aanbrengen. Bij jongens kan zaad ingevroren worden, bij meisjes kan ovariumweefsel (eierstokken) worden ingevroren.
Invriezen sperma voor later gebruik
De testikels (zaadballen), de plaats waar de zaadcellen worden aangemaakt, kunnen daardoor ook aangetast worden. Dit kan tijdelijke of blijvende onvruchtbaarheid veroorzaken. Daarom is het voor patiënten die een vruchtbaarheidsbedreigende behandeling zullen ondergaan aan te raden om sperma in te vriezen om eventueel later te gebruiken.
Cryopreservatie van de eierstok
Cryopreservatie van de eierstok (ovarium) is een nieuwe ontwikkeling in Nederland, die in verschillende universitaire ziekenhuizen toegepast wordt. Er wordt tijdens een kijkoperatie (laparoscopie) één van de 2 eierstokken weggehaald en ingevroren in de vloeibare stikstof. Wanneer na de chemotherapie blijkt dat de vrouw onvruchtbaar is op grond van onwerkzame eierstokken, kan de ingevroren eierstok teruggeplaatst worden. Alhoewel een veelbelovende techniek, is de ervaring hiermee nog zeer gering. Deze vorm van bewaren van de vruchtbaarheid wordt aangeboden aan meisjes die al met de menstruatie begonnen zijn, en die dit graag willen.
Beenmergeffecten
Door chemotherapie kan er remming zijn van de aanmaak van nieuwe bloedcellen. Deze remming kan een anaemie (tekort aan rode bloedcellen, dit geeft bloedarmoede), leucopenie (te weinig witte bloedcellen) en/of trombocytopenie (te weinig bloedplaatjes) veroorzaken. Rode bloedcellen zorgen voor het vervoer van zuurstof. Symptomen van anaemie kunnen zijn: bleekheid, duizeligheid, hoofdpijn, hartkloppingen, kortademigheid, vermoeidheid, koud voelen. Witte bloedcellen zorgen voor bescherming tegen infecties. Controleer wondjes op roodheid, pijn en zwelling. Zorg voor goede lichaamshygiëne, goede mondverzorging.
Bloedplaatjes zorgen voor de stolling (stoppen van een bloeding). Men heeft een verhoogde kans op een neusbloeding, blauwe plekken en bloed bij plassen of hoesten. Een menstruatie kan meer bloedverlies geven dan voorheen.
Mondslijmvlies
Door de chemotherapie kan er irritatie, beschadiging, of een ontsteking van het mondslijmvlies en tandbederf optreden. Veranderingen aan het mondslijmvlies kunnen zijn: droge mond, gevoeligheid bij het eten of drinken van zure of gekruide spijzen en dranken, gevoeligheid voor de temperatuur van eten en drinken, slechte adem, snel bloedend tandvlees, taai speeksel. Het is belangrijk dat de mondholte goed verzorgd wordt.
Perifere zenuwstelsel
Door de chemotherapie kan men last krijgen van een tintelend of doof gevoel in de vingertoppen, voetzolen of tenen, dit kan soms tot 1 jaar na de chemotherapie. Koude kan deze klachten verergeren.
Psychosociaal
De diagnose kanker heeft een grote impact in het leven van mensen. Ook de vaak belastende behandelingen hebben grote invloed op het psychisch en sociaal welbevinden. Kanker tast niet alleen het lichaam aan, maar beïnvloedt alle levensterreinen. De ziekte vergt veel van het aanpassingsvermogen van mensen. De wijze waarop mensen omgaan met de gevolgen van de diagnose kanker en de behandeling heeft grote invloed op hun kwaliteit van leven. Iedere kankerpatiënt staat voor de opgave een nieuw evenwicht te vinden in het leven. Psychosociale zorg richt zich op het herstel van de kwaliteit van leven (www.lkcnet.nl).
Mogelijke complicaties van de operatie
Wondinfectie
De kans hierop is klein. Over het algemeen als er wondinfecties optreden treedt dit meestal binnen een week op. Wondinfecties zijn zichtbaar door roodheid en/of pijn aan de wond en door temperatuurverhoging. Behandeling kan bestaan uit rust, antibiotica en soms operatief. Indien er verdenking is op een wondinfectie moet u contact op nemen met de afdeling orthopedie (dienstdoende orthopeed).
Trombose
Alle mensen die een langdurige operatie ondergaan aan één van de ledematen hebben meer kans op het krijgen van trombose (aderverstopping door een bloedstolsel). Om dit te voorkomen krijgt u vanaf de operatie bloedverdunnende medicijnen in injectievorm gedurende een periode van 6 weken. Een trombosebeen kan zelfs ontstaan bij gebruik van deze medicijnen.
Beschadiging van een zenuw
Tijdens de operatie kan een zenuw opgerekt, bekneld raken of afhankelijk van de soort operatie doorgenomen worden.
Loslaten van de prothese
Soms kunnen prothesen loslaten en is een nieuwe operatie meestal noodzakelijk.
Meedoen aan wetenschappelijk onderzoek
Zoals eerder gezegd worden patiënten met een osteosarcoom in Leiden behandeld in studieverband, volgens de EURAMOS-1 studie. Er is een duidelijk voordeel om deze intensieve multidisciplinaire behandeling in studie verband uit te voeren. Het protocol is dan uniform met frequente (lange termijn) controles.
Welke specifieke nazorg kunnen we bieden bij deze aandoening?
Medische Nazorg/ Follow up
Steeds meer patienten met kanker overleven, door verbeterde diagnostiek en behandelingsmethoden. Dit is een mooie vooruitgang, maar deze heeft ook een keerzijde. Bij een deel van de patiënten blijken er late effecten van de behandeling voor te komen. Deze effecten kunnen variëren van specifiek lichamelijk tot psychosociaal. Van het medicijn andriamycine bijvoorbeeld weten we inmiddels dat die op latere leeftijd hartschade kan veroorzaken. Maar er kunnen ook leer- en aandachtsproblemen ontstaan of problemen op het gebied van de vruchtbaarheid en de groei. Deze “late” effecten kunnen de kwaliteit van leven beïnvloeden, en soms ook verdere medische zorg noodzakelijk maken. Om deze redenen blijft u jarenlang onder controle. De eerste jaren intensief en later jaarlijks.
Fysiotherapie / revalidatie
Afhankelijk van de operatieve ingreep wordt al snel na de operatie gestart met de revalidatie behandeling. Gedurende de postoperatieve chemotherapie wordt deze behandeling vooral uitgevoerd en gecoördineerd vanuit het ziekenhuis, soms wordt ook een fysiotherapeut in de eigen woonplaats bij de behandeling betrokken. Bij de knie operaties wordt na enkele dagen gestart met een “motorslede” die meerdere uren per dag het been voorzichtig beweegt.
Indien een donorbot reconstructie is verricht, wordt het been gedurende een periode van 6 - 12 maanden met behulp van een koker of brace beschermd. De revalidatie na de operatie met de chemotherapie duurt zes maanden tot een jaar. Zware fysieke arbeid of belastende sporten, zoals skiën, paardrijden of voetballen zijn voor patiënten met een reconstructie beperkt mogelijk. Fietsen, wandelen, golfen of zwemmen, kunnen bijvoorbeeld wel. Na een tumorprothese reconstructie is een brace of koker meestal niet nodig en enkele weken na de operatie kan de prothese belast worden.
Bij een amputatie van (een deel van) het been wordt na het verwijderen van het stompgips enkele dagen na de operatie gestart met het zwachtelen van de stomp en met staan en lopen onder leiding van de fysiotherapeut. Na enkele weken komt de prothesemaker en kan als de prothese klaar is gestart worden met de prothese training. De revalidatie na een amputatie start al kort na de ingreep en afhankelijk van de hoogte van de amputatie is zware belasting en sport mogelijk. Vooral jongere patiënten worden gestimuleerd om actief aan sport te gaan doen. Zij worden geïnformeerd over sportactiviteiten zoals skiën op één been en atletiek.
De revalidatie en het aanmeten van een prothese na een omkeerplastiek start na enkele weken. Met deze prothese is een goed looppatroon mogelijk evenals zware belasting en sport.
Behandelteam
Het behandelteam
Iedere patient met een osteosarcoom wordt behandeld door een multidisciplinair behandelteam met veel ervaring in de behandeling van deze zeldzame aandoening. Er zijn vier behandelteams in Nederland actief, te weten; AMC in Amsterdam, UMCG in Groningen, UMCN in Nijmegen en LUMC in Leiden. Het team bestaat o.a. uit een (kinder)oncoloog, orthopeed, radioloog, patholoog, radiotherapeut, (thorax)chirurg, neurochirurg, revalidatiearts, fertiliteitstarts, orthopedisch instrumentmaker, maatschappelijk werk, fysiotherapeut, pedagogisch medewerker, oncologie verpleegkundige en verpleegkundig specialist. Aangezien de afwijking in het bot zit is het eerste contact in het ziekenhuis meestal via de orthopeed. Gedurende het behandelingstraject is het multidisciplinaire team permanent bij de behandeling betrokken. De hoofdbehandelaar wisselt afhankelijk van het stadium waarin de patiënt zich bevindt, bijvoorbeeld tijdens de chemotherapie is dit de oncoloog, tijdens de chirurgie de orthopeed. Het beleid wordt tijdens het wekelijkse multidisciplinair overleg besproken.
Aan welke studies kan je meedoen?
EURAMOS-1 studie
Zoals al genoemd worden patiënten met een osteosarcoom in Leiden behandeld in studieverband. Er is een duidelijk voordeel om deze intensieve multidisciplinaire behandeling in studie verband uit te voeren. Het protocol is dan uniform met frequente (lange termijn) controles. Met deze vorm van samenwerking betekent dat er meestal geen verschil is in behandeling binnen vier centra (AMC in Amsterdam, UMCG in Groningen, UMCN Radboud in Nijmegen en LUMC in Leiden) in Nederland, binnen in Europa en de Verenigde Staten.
Pre-klinisch onderzoek naar de oorzaak en behandeling van osteosarcoom krijgt in Leiden ruime aandacht. Dit is onderzoek waaraan verschillende disciplines meewerken, zoals de pathologie, moleculaire biologie, genetica, orthopedie, medische en kinderoncologie, radiodiagnostiek, radiotherapie, immunologie en farmacologie. Er zijn een aantal onderzoeksprojecten die meer afdelingsgebonden zijn, zoals bijvoorbeeld onderzoek naar de immunologische mechanismen van het osteosarcoom. Ook zijn er grootschalige internationale projecten, waar onderzoekers uit Leiden een prominente rol in spelen. Uiteindelijk moet het resultaat van dit onderzoek leiden tot een beter begrip van de aard en de behandeling van het osteosarcoom.